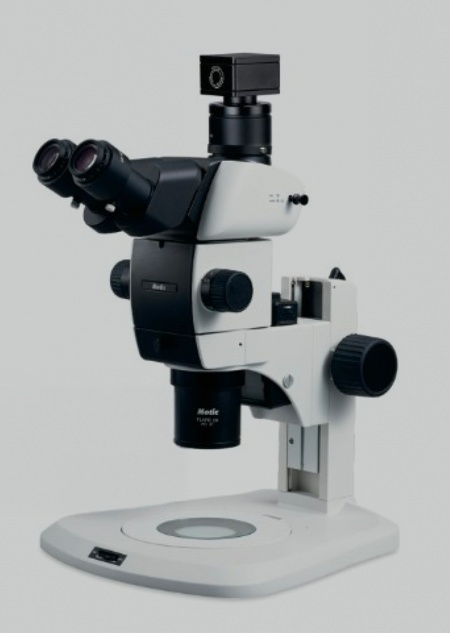
类器官技术模型的构建与倒置显微镜
类器官技术作为近年来生物医学领域的前沿突破,通过体外三维培养实现了对真实器官结构与功能的模拟,为疾病研究、药物筛选及再生医学提供了革命性工具。本文将结合其技术流程,解析类置显微镜在类器官研究中的核心应用。
一、类器官技术的关键流程
1. 细胞来源与分离
类器官的构建始于细胞的选择,常用来源包括患者组织(如肿瘤活检)、多能干细胞(iPSCs、ESCs)或成体干细胞。例如,肺癌类器官常从患者肿瘤组织中提取原代细胞,通过胶原酶/分散酶消化获得单细胞悬液。此时,倒置显微镜可初步观察细胞分离效果,确保组织解离充分且细胞活性达标。
2. 三维培养体系的建立
分离后的细胞需接种于基质胶(如Matrigel)中,形成三维结构。基质胶与细胞悬液按比例混合后,滴入培养板并固化,覆盖特定培养基(含生长因子如EGF、bFGF及ROCK抑制剂Y27632)。倒置显微镜在此阶段用于实时监测细胞分布均匀性及初始聚集状态,避免气泡或胶体不均匀影响类器官形成。
3. 类器官的动态培养与监测
培养过程中,类器官的形态变化需持续追踪。例如,肠类器官会逐渐形成隐窝-绒毛样结构,而肿瘤类器官则保留原发组织的异质性。倒置显微镜凭借其物镜位于载物台下方的设计,可无损观察培养皿或孔板中的三维类器官,配合相差或荧光模块,实现活细胞动态成像。研究人员可通过时间序列拍摄,量化类器官生长速率、囊腔形成等关键参数。
4. 传代与功能验证
当类器官生长至一定规模时,需通过酶消化(如胰蛋白酶)解离并重新接种以扩增。倒置显微镜在此环节辅助评估解离效果,确保类器官碎片大小适宜。后续功能验证中,倒置荧光显微镜可结合免疫荧光标记(如CK7、TTF-1等肺癌标志物)或钙离子探针,解析类器官的分子特征及电生理活动。
二、倒置显微镜的技术优势
1. 活细胞成像与无损观测
倒置显微镜的光路设计使其特别适合观察底部贴壁或悬浮的三维类器官。相较于正置显微镜,其长工作距离物镜(如40×/0.6 NA)可穿透培养基底质(如基质胶),捕捉类器官内部细节。例如,在脑类器官研究中,可通过延时摄影记录神经突触的延伸与网络形成。
2. 多模态成像整合
现代倒置显微镜常集成相差、荧光、DIC等多种成像模式。荧光模块可用于检测类器官的特定标记物(如肿瘤特异性抗原),而相差成像则无需染色即可观察形态。此外,共聚焦倒置显微镜可实现高分辨率三维重构,揭示类器官的亚细胞结构。
3. 高通量筛选支持
结合自动化平台,倒置显微镜可对96/384孔板中的类器官进行高通量成像,加速药物筛选流程。例如,在抗癌药物测试中,可通过定量分析类器官体积变化或凋亡标记物表达,快速评估药效。
三、未来展望
类器官与倒置显微镜的结合正在推动精准医学的革新。随着类血管化、神经支配等技术的突破,倒置显微镜将进一步整合人工智能图像分析,实现类器官发育的自动化追踪与表型量化。此外,基于微流控的“器官芯片”与高内涵成像的结合,有望在类器官模型中模拟更复杂的生理微环境。
下一篇:结构光光切显微技术